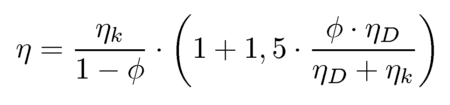- 6.1. Definition und Einteilung
- 6.2. Lösungen
- 6.3. Suspensionen
- Allgemeines Suspensionsverhalten
Stabilität einer Suspension
- 6.4. Emulsionen
- Tropfen im Scherfeld
Herstellung von Emulsionen
Rheologie von Emulsionen
Bei einem dispersen System liegt ein zwei-bzw. mehrphasiges
System vor, in dem eine zusammenhängende Phase bzw. Phasenmischung
(Dispersionsmittel, z.B. Lösungsmittel) finite Volumina weiterer
Phasen (Dispergent, Disperse Phase, z.B.
Tropfen, Partikeln, Blasen) enthält.
Eine Einteilung der dispersen Systeme kann erfolgen nach:
Aus rheologischer Sicht werden disperse Systeme mit einer homogen
verteilten dispersen Phase häufig als eine einzige kontinuierliche
Phase mit makroskopischen Fließeigenschaften betrachtet.
Im Folgenden wird auf das Fließverhalten einiger disperser
Systeme näher eingegangen.
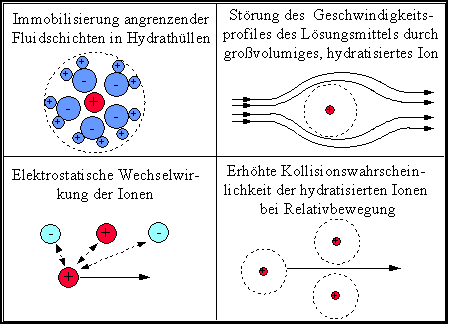
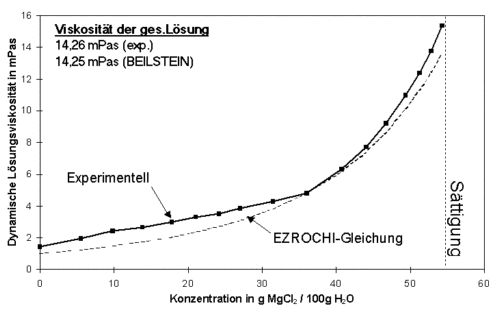
In diesem Abschnitt soll es um Lösungen bzw. spezieller um wäßrige Elektrolyte und ihr Fließverhalten gehen. Durch das Auflösen bzw. Dissoziieren eines Salzes in Wasser kommt es insbesondere zu zwei Effekten. Zum einen bewirken die dissoziierten Ionen eine Strukturierung im angrenzenden Lösungsmittel, zu der auch die Bildung von Hydrathüllen um die Ionen zu zählen ist. Ein weiterer Effekt resultiert aus der elektrostatischen Wechselwirkung der dissoziierten Ionen. Entsprechend Abb. 6.1 solten beide Effekte zu einer behinderten Relativbewegung von Fluidschichten und somit zu einer erhöhten Viskosität des Systems gegenüber dem reinen Lösungsmittel führen. Bis auf wenige Ausnahmen (Ionen mit strukturbrechender Wirkung, z.B. K+) und dann auch nur für sehr dünne Lösungen trifft diese Aussage zu. Wesentlichste Einflußfaktoren für die Viskositätserhöhung sind dabei die Ionenart (insbesondere die Ladung) und ihre Konzentration. Abb. 6.2 zeigt am Beispiel einer Magnesiumchlorid-Lösung den Einfluß der Elektrolytkonzentration auf die dynamische Viskosität einer Lösung.
Eine Gleichung, die diese Effekte berücksichtigt und eine Vorhersage für die Elektrolytviskosität bis zu Konzentrationen von 0,25mol/l ermöglicht, ist die DOLE-JONES-Beziehung :
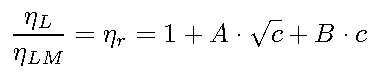
Die relative Viskosität hr als Quotient von Lösungs- und Lösungsmittelviskosität
ergibt sich aus einer Funktion der Konzentration und zweier Koeffizienten
A und B. Der Koeffizient der Wurzelabhängigkeit
A beschreibt die elektrostatischen Wechselwirkungen der
Ionen und wird auch als FALKENHAGEN-VERNON-Koeffizient bezeichnet.
Er ist abhängig von verschiedenen Ionen- und Lösungsmitteleigenschaften
und wird meist aus experimentellen Werten (Ordinatenschnittpunkt
in der Darstellung (hr-1)
/ c^½=f(c^½) ) ermittelt. Der Koeffizient B
beschreibt die Wechselwirkungseffekte von Ionen und Lösungsmittelmolekülen
und stellt den Anstieg in der gesnannten Darstellung dar. Er ergibt
sich aus der Summe der B-Koeffizienten der beteiligten Ionenarten,
die in Tabellenwerken (z.B. Yitzak Marcus, "Ion Properties",
Marcel Decker, N.Y.,1997) zu finden sind. Negative Werte zeigen
eine strukturbrechende Wirkung der Ionenart an, während positive
Werte für eine Strukturbildung im Lösungsmittel sprechen.
Bei der Anwendung der DOLE-JONES-Gleichung ist zu beachten, daß
die Koeffizienten A und B temperaturabhängig
sind und die Gültigkeit auf relativ geringe Konzentrationen
beschränkt ist. Eine Erhöhung der Temperatur führt
zu einem verminderten Einfluß der Wechselwirkungen auf das
Fließverhalten und so zu veränderten Viskositäten.
Bei hohen Konzentrationen sorgen Mehrteilcheneffekte für
einen überlinearen Anstieg der Viskosität (siehe
oben). Eine Formulierung, die den Temperatureffekt in Systemen
mit den Ionen Na+, K+, Mg2+,Cl- und
SO4 2- beschreiben kann und auch
für hohe Konzentraitonen gültig ist (siehe auch Abb.
6.2.2), stellt die EZROCHI-Gleichung dar:
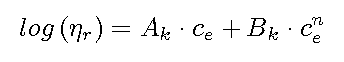
Die Konzentration ce ist eine Äquivalentkonzentration, die sich aus der Stöchiometrie n und der Ladungszahl z der Kationen in der jeweiligen Verbindung ergibt :
Die Faktoren Ak und Bk sind einschließlich deren Temperaturabhängigkeit für die genannten Verbindungen bekannt und können verschiedenen Literaturquellen (z.B. S.Weiss, "Verfahrenstechnische Berechnungsmethoden, Teil7 -Stoffwerte", VCH, Weinheim, 1985) entnommen werden. Für Mischungen der oben genannten Elektrolyte kann folgende Abart der EZROCHI-Gleichung genutzt werden, wobei sich die Gesamtäquivalentkonzentration ce,ges als Summe der einzelnen Äquivalentkonzentrationen ergibt:
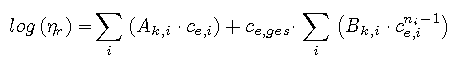
6.3. Suspensionen
Allgemeines Suspensionsverhalten
Bei einer Suspension sind Partikeln eines Feststoffes in einer Flüssigkeit verteilt. Erfolgt diese Verteilung homogen, kann die Suspension makroskopisch als Kontinuum betrachtet werden. Phasentheoretisch liegt dieses System zwischen den beiden Grenzfällen Feststoff und Flüssigkeit. Dies zeigt sich auch in ihrem Verhalten unter Deformation. So zeigt eine Suspension sowohl das viskose Verhalten eines Liquids wie auch das plastisch-elastische Verhalten eines Feststoffes. Die Dominanz einer dieser Verhaltensweisen wird insbesondere durch den Volumenanteil des Feststoffes am Gesamtsystem :
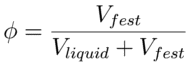
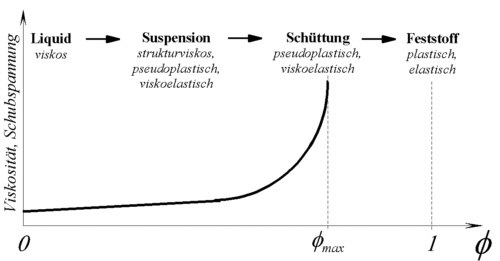
bestimmt. Abb. 6-3 zeigt schematisch die Auswirkungen dieser Größe auf den Widerstand (Schubspannung) des Materials gegen eine konstante Scherdeformation. Ausgehend von der vergleichsweisen geringen Zähigkeit eines Liquids steigt die Schubspannung bei Zugabe von Feststoffpartikeln zunächst linear mit dem Feststoffgehalt an. Dieser lineare Anstieg resultiert aus der Störwirkung der Feststoffpartikeln auf das Strömungsprofil des Liquids (siehe auch Abb.6-1) und der damit verbundenen erhöhten Dissipation. Beschrieben wird dieser Störeffekt eines Einzelpartikels durch die EINSTEIN-Beziehung:
Suspensionen mit solch einem linearen Verhalten werden auch als dünne Suspensionen bezeichnet. Kommt es zu einem überlinearen Anstieg der Schubspannung bzw. Viskosität, dann spielen Mehrteilcheneffekte eine Rolle. So wird ein Volumenelement des Fluids hier durch die Gegenwart mehrerer Feststoffpartikeln in seiner Fließbewegung so gestört, daß eine im Vergleich zur Störwirkung eines Einzelpartikels größere Dissipation erfolgt. Einen weiteren Beitrag liefern die Wechselwirkungen zwischen Partikeln, die sogenannten interpartikulären Wechselwirkungen. Hierzu zählen Partikelkollisionen wie auch anziehende und abstoßende Kräfte. Anziehende Kräfte wie die Van-der-Waals-Wechselwirkung können zur Bildung von Flocken bzw. Flockennetzwerken führen. Die Deformation solcher Systeme verlangt einen erhöhten Kraftaufwand (höhere Schubspannung). Der gleiche Effekt wird durch abstoßende wie z.b elektrostatische Kräfte erzeugt. Wollen sich hier Partikeln aneinander vorbeibewegen, so sind diese abstoßenden Kräfte zu überwinden. Kollisionen zwischen Partikeln führen zu einem Impulsaustauch und einer erhöhten Dissipation. Mit dem Feststoffvolumengehalt steigt die Anzahl der Partikeln im System und damit auch die Häufigkeit von Kollisionen. Als Parameter hierfür kann der Partikeloberflächenabstand herangezogen werden, der auch für die Stärke der anziehenden und abstoßenden Kräfte entscheidend ist. Er ergibt sich näherungsweise für ein monodisperses System zu:
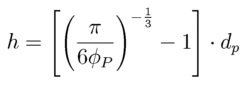
Die Beziehung macht deutlich, daß die Stärke der interpartikulären Wechselwirkungseffekte nicht nur vom Feststoffvolumengehalt sondern auch von der Partikelgröße abhängt. So steigt die Schubspannung einer Suspension bei vergleichbaren Bedingungen mit Verkleinerung der Partikelgröße zum Teil deutlich an. Abb.6-4 zeigt beispielhaft die gemessenen Werte für die relative Viskosität (hsusp./hflüssig) in Suspensionen von KCl- bzw. NaCl-Kristallen in Silikonöl als Funktion des mittleren Kristalldurchmessers. Die Differenzen zwischen beiden Materialien resulieren aus einer unterschiedlichen Van-der-Waals-Wechselwirkung. Die HAMAKER-Konstante als Maß für deren Stärke liegt für NaCl bei 4,7·10^-20 J und für KCl bei 3,99 ·10^(-20) J.
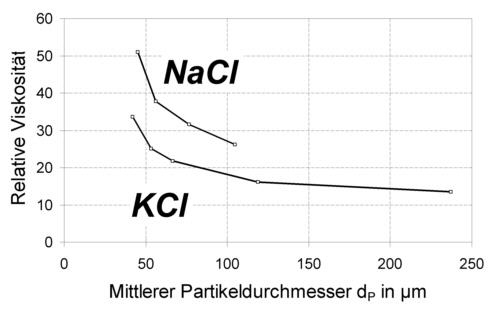
Abb. 6-4 : Einfluß der Partikelgröße auf die relativen Viskositäten verschiedener Salz-Silikonöl-Suspensionen (Feststoffgehalt 40 Vol-%, Schergeschwindigkeit 100 1/s, Temperatur 20°C)
Der überlineare Anstieg der Schubspannung mit dem Feststoffvolumengehalt kann durch Anwendung empirischer bzw. halbempirischer Beziehungen charakterisiert werden. Nach den Erfahrungen des Autors lassen sich Meßwerte besonders gut mit der EILERS-Beziehung beschreiben:
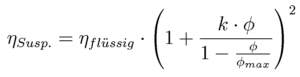
Dabei ist der Parameter fmax die Feststoffvolumenkonzentration, bei der der Übergang von der Suspension zur Schüttung erfolgt (maximale Packungsdichte-siehe Abb.6-3). Anhand dieses Parameters läßt sich der Einfluß verschiedener Größen auf die Suspensionsviskosität erklären. So ist bei einer Schüttung von Partikeln ohne Kugelform (z.B. Nadeln, Plättchen) im statistischen Mittel von einer geringere Schüttdichte entsprechend einem kleineren Parameter fmax auszugehen. Daher sind bei diesen Partikelformen höhere Schubspannungen bzw. Viskositäten zu erwarten. Eine Veränderung der Suspensionszähigkeit wird auch durch die Breite der Partikelgrößenverteilung ausgelöst. Je breiter die Verteilung destso höher ist bei gleichem mittleren Partikeldurchmesser auch die Packungsdichte der Schüttung und umso kleiner wird die Viskosität der Suspension. .
Einer der wichtigsten Einflußgrößen des Fließverhaltens einer Suspension stellt die Schergeschindigkeit dar. So zeigen Suspenionen ein ausgeprägtes Nicht-Newtonsches speziell pseudoplastisches Verhalten. Dabei sinkt die Zähigkeit mit der Intensivierung der Scherung, was sich bei Betrachtung des Kollisionsverhaltens der Partikeln erklären läßt (Abb. 6-5).
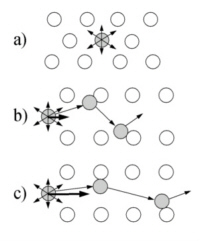
Im Ruhezustand führen die Partikeln eine thermische Bewegung (Brownsche Bewegung) aus (a), die keine bestimmte Richtung bevorzugt. Kommt es zu einer überlagerten Relativbewegung zwischen Partikeln, so werden Partikeln ihre Bahnen verlassen und in die benachbarten Partikelschichten eindringen. Dort kommt es dann zu Kollisionen. Bei kleiner Relativbewegung (b) können die Partikeln dabei weit in die benachbarte Schicht eindringen (größerer zeitlicher Abstand zwischen Partikeln der Nachbarschicht). Entsprechend "voll" sind die Stöße (hoher Impulsaustausch) und eine hohe Zähigkeit entsteht. Die vollen Stöße führen dabei auch zu einer vergrößerten Querbewegung und somit zu einer Verstärkung des beschriebenen Eindringeffektes. Steigt die Relativgeschwindigkeit zwischen Partikeln, so nimmt die Eindringtiefe in die benachbarten Schichten ab. Dies führt zu vergleichsweise seichten Stößen mit geringem Impulsaustausch (geringere Zähigkeit). Das Nicht-Newtonsche Verhalten einer Suspension zeigt sich in der Fließkurven derartiger Stoffsysteme. Abb. 6-6 zeigt Meßwerte einer Gips-Silikonöl-Suspension und mögliche Modelle zur Beschreibung des Fließverhaltens einer Suspension.
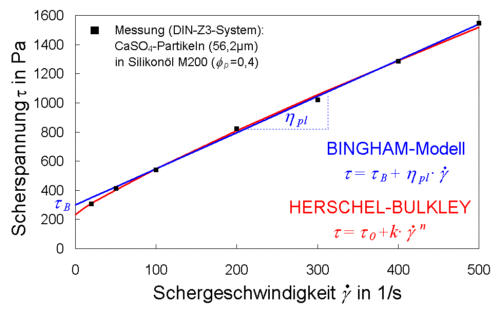
Die Schubspannungswerte steigen dabei analog einem Newtonschen Liquid näherungsweise linear mit der Scherrate (BINGHAM-Modell), wobei die Fließkurve hier scheinbar nicht durch den Nullpunkt geht. Vielmehr kreuzt sie die Ordinate bei einer Schubspannung tb. Diese Größe ist physikalisch als eine notwendige Spannung zur Überwindung der Ruhestruktur und zur Auslösung des Fließvorganges zu verstehen. Sie wird daher auch als Fließgrenze bzw. speziell beim BINGHAM-Modell auch BINGHAM-Fließgrenze genannt. Unterhalb der Fließgrenze werden lediglich reversible Verformungen der Struktur (elastisches Verhalten) ausgelöst. Insbesondere im technologisch wichtigen Bereich kleiner Schergeschwindigkeiten (<100 1/s) reicht die lineare Beschreibung der Meßwerte oft nicht aus. Hier bietet das Potenzmodell nach HERSCHEL-BULKLEY eine bessere Anpassung. Nachteil dieses 3-parametrigen Modelles ist jedoch deren komplizierte Anwendbarkeit auf technologische Problemstellungen (z.B. Druckverlustberechnung im Rohr).
In diesem Abschnitt steht die Stabilität einer Suspension im Vordergrund. Unter Stabilität soll dabei der Widerstand gegen die Entmischung von Feststoff- und Liquidphase bzw. die Erhaltung einer makroskopisch homogenen Feststoffverteilung verstanden werden. Eine hohe Stabilität bringt dabei meist auch einen hohen Deformationswiderstand, insbesondere hohe Fließgrenzen mit sich. Ursache für eine Entmischung der Phasen bzw. Destabilisierung sind Feldkräfte wie die Gravitation. Bei einem Dichteunterschied zwischen Feststoff und Fluid kommt es durch Sedimentation zur Bildung eines feststofffreien Überstandes und eines Sedimentes mit maximaler Packungsdichte f max. Die Sedimentationsneigung bzw. -geschwindigkeit wird dabei verschiedene Parameter bestimmt. Geringe Dichteunterschiede, kleine Partikelgrößen, hohe Feststoffvolumengehalte (Schwarmwirkung) und hohe Dispersionsmittelviskositäten behindern den Sedimentationsvorgang. Dies gilt auch für die ungerichtete thermische Bewegung (Brownsche Bewegung) der Partikeln.
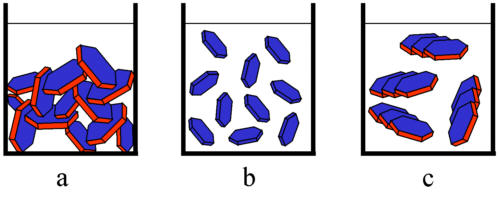
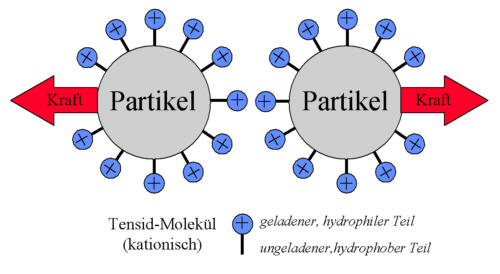
Die Van-der-Waalsschen Anziehungskräfte führen zum Agglomerieren von Partikeln. Bilden sich dabei großvolumige Flocken, so wird die Sedimentation und damit die Entmischung beschleunigt (Abb. 6-7c). Führt die Agglomeration aber zur Bildung eines durchgehenden Netzwerkes (Gelbildung, Abb. 6-7a) so resultiert eine stabilere Struktur. Einen ebenfalls stabilisierenden Effekt haben abstoßende Kräfte zwischen den Partikeln, die diese in Schwebe halten. Dabei sind zwei grundsätzliche Mechanismen, die elektrostatische und die sterische Stabilisierung zu unterscheiden. Elektrostatische Abstoßungskräfte entstehen, wenn Partikeln eine Oberflächenladung tragen. Dann bilden sich über den Partikeloberflächen in einem angrenzenden Elektrolyten Grenzflächensysteme (Doppelschichten) heraus, die sich überlappen und zu einer abstoßenden Wirkung führen (Abb.6-7b). Charakterisiert werden kann dieser Abstoßungseffekt durch das sogenannten Zeta-Potential, das in elektrokinetischen Messungen zugänglich ist. Diese elektrostatischen Abstoßungskräfte sind insbesondere dann als relevant zu betrachten, wenn die Flüssigkeit ein Elektrolytsystem geringer bis mittlerer Konzentration (z.B. Leitungswasser) ist und eine ausreichende Oberflächenladung der Partikeln vorliegt. Die Oberflächenladung kann bereits natürlich vorliegen (Dissoziation von Oberflächengruppen) oder durch Zugabe von Tensiden bzw. Polyelektrolyten (Peptisatoren) erzeugt werden. Letztere Stoffe adsorbieren auf den Partikeloberflächen und sorgen mit ihren geladenen Kopfgruppen für eine Oberflächenladung der Partikeln (Abb. 6-8). Dieser Effekt wird beim klassischen Waschvorgang ausgenutzt. Abgelöste Schmutzteilchen werden dort von geladenen Tensidmolekülen überzogen. Die resulierende Abstoßung der Schmutzpartikeln hält diese dann zum späteren Abtransport in der Lösung (Solubilisieren). Sterische Effekte resulieren aus der Wechselwirkung von Polymerketten. Nähern sich Moleküle mit adsorbierten Polymeren einander, so kommt es zur Durchdringung der Polymerketten bzw. sogar zu deren Stauchung. Folge ist eine Abstoßungswirkung, die die Flockung der Partikeln verhindernd und somit stabilisierend wirkt.
Soweit zu einigen kurzen Ausführungen zur Stabilität von Suspensionen. Vertiefte, insbesondere quantitative Aussagen konnten hier nicht vorgestellt werden. Diese sollten spezieller Literatur zur Kolloidchemie (z.B. H.-D. Dörfler, "Grenzflächen- und Kolloidchemie", VCH, Weinheim, 1994) entnommen werden.
6.4. Emulsionen
Tropfen im Scherfeld
In einer Emulsion ist eine Flüssigkeit in Form disperser
Tröpfchen in einer zusammenhängenden, kontinuierlichen
Flüssigkeit verteilt. In ihrer Rheologie, Struktur und Stabilität
zeigen die zuvor behandelten Suspensionen und Emulsionen zum Teil
ein gemeinsames Verhalten, aber auch gravierende Unterschiede.
Letztere basieren insbesondere auf:
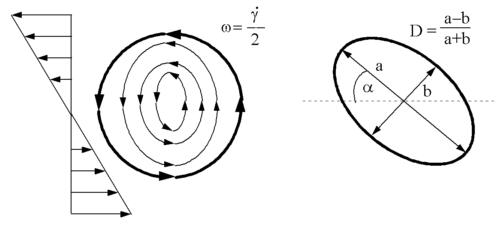
Einige der damit verbundenen Effekte werden folgend behandelt. Zunächst soll es um die Deformation der Tropfen in einem Scherfeld gehen. Im Ruhezustand sind die Tropfen einer Emulsion nach einer möglichst geringen Grenzfläche bemüht und nehmen daher eine Kugelform an. In einem Scherfeld wird durch die Spannungszustände an der Tropfenoberfläche eine Deformation als auch eine Zirkulationsströmung im Innern des Tropfens ausgelöst. Letztere kann man sich als Ergebnis einer rotierenden Oberfläche vorstellen (Abb. 6-9). Diese überträgt eine Rotationsströmung an die Tropfenflüssigkeit. Durch Deformation im Scherfeld nimmt dabei eine elipsoide Form an, die durch das Verhältnis der Hauptachsen D und den Winkel a zwischen Hauptachse und Strömungsrichtung (Abb.6-9) beschrieben werden kann. Nach COX ergeben sich diese Größen in Abhängigkeit von Scherrate, Oberflächenspannung s und dem Verhältnis k der Viskosität von disperser Phase hd und kontinuierlicher Phase hk sowie dem Tropfendurchmesser d zu:
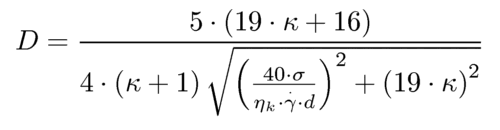
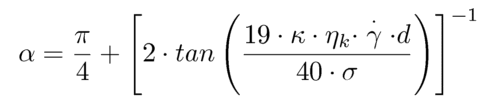
Bei starken Deformationen (z.B. im Turbulenzfeld) kann es zu einem Zerfall in kleinere Tropfen (Emulgieren) kommen. Eine definitive Aussage dazu, wann und wie dieser Zerfall eintritt ist nicht möglich. Insbesondere Art und Stärke der Deformation, die Viskositäten der Fluide und der Tropfendurchmesser entscheiden über einen Tropfenzerfall. In einer einfache Scherströmung gilt dabei insbesondere:
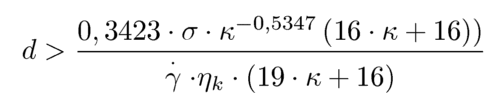
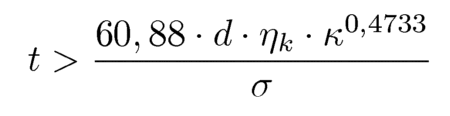
Erhöht wird die Zerfallswahrscheinlichkeit durch Anwendung
kombinierten Dehn-Scher-Beanspruchungen bzw. bei turbulenter Strömung.
Die Größe bzw. Größenverteilung der entstehenden
Tropfen ist ebenfalls eine Frage der Deformation bzw. Strömungsverhältnisse.
Da hier die Größe der Grenzfläche (Tropfenoberfläche)
entscheidender Stabilitätsfaktor ist, wird häufig die
spezifische Oberfläche bzw. der oberflächengemittelte
Durchmesser (Sauter-Durchmesser) zur geometrischen Beschreibung
von Emulsionen verwendet.
Das Betreben der Phasen nach einer möglichst kleinen Grenzfläche,
ausgedrückt in Form der Oberflächenspannung, macht
Emulsionen zu instabilen Systemen. Die Verbindung zweier Tropfen
zu einem Einzeltropfen (Koaleszens) führt zu einer Verringerung
der spezifischen Tropfenoberfläche (Grenzfläche) und
ist daher ein freiwiller Vorgang. Diese Tropfenkoaleszens wird
solange fortgesetzt, bis eine minimale Grenzfläche erhalten
wird. Dies tritt bei vollständiger Entmischung der Phasen
ein. In einer Strömung bzw. bei Deformation hat man es mit
einer fortwährenden Tropfenteilung und Koaleszens zu tun.
Die Strömungsverhältnisse entscheiden dabei über
die Lage des Gleichgewichtes bzw. über die Tropfengröße.
Die Neigung zur Koaleszens kann dabei durch Einsatz oberflächenaktiver
Stoffe (Emulgatoren) erhöht werden. Diese makromolekularen
Stoffe adsorbieren auf der Oberfläche der Tropfen
und behindern den zur Koaleszens notwendigen Kontakt der Oberflächen
zweier Tropfen. Tragen diese Makromoleküle zusätzlich
geladene Kopfgruppen, so kann analog Abb.6.8
durch elektrostatische Abstoßung der Oberflächen die
Stabilität der Emulsion erhöht werden.
Eine Emulsion herstellen kann man prinzipiell in jeder Strömung,
sofern die Spannungszustände für eine Teilung der Tropfen
ausreichen. Technologisch wird weniger eine makroskopische Scher-
oder Dehnströmung als vielmehr die Wirkung der Turbulenz
ausgenutzt. Zum Emulgieren werden vorrangig Rührmaschinen
und Rohre eingesetzt. In Rohren wird in Wandnähe aufgrund
der dort vorherrschenden starken Turbulenz eine Tropfenteilung
erreicht. Der Emulgiereffekt kann dabei durch Einsatz geeigneter
Einbauten, z.B. Dispergierblende oder Lochplatten, verstärkt
werden. In Rührbehältern entscheidet neben den Betriebsgrößen
die Art des Rührers, die Einbauparameter und die Behältereinbauten
über das Emulgierergebnis. Schaufel- als auch Blattrührer
und Dispergierscheiben sind besonders für das Emulgieren
geeignet. Strombrecher im Behälter verstärken den Emulgiereffekt.
Die erreichbare Tropfengröße beim Emulgieren hängt
neben Stoffsystem und Apparateart -und gestaltung auch von Betriebsgrößen
(z.B. Drehzahl) ab. Die Literatur bietet hier einige Beziehungen,
die eine Abschätzung der Tropfengrößen für
verschiedene Apparate bzw. Strömungen bieten (Verfahrenstechnische
Berechnungsmethoden- Teil4: Stoffvereinigen in fluiden Phasen,
VCH-Verlag, Weinheim, 1988).
Die Schwierigkeiten bei der rheologischen Beschreibung von
Emulsion liegt im Vergleich zur Suspension in den variablen geometrische
Parametern. So kann eine Scherdeformation zu einer Tropfenteilung
und damit einer veränderten Größenverteilung führen.
Diese Wert bestimmt die Größe der Grenzfläche
und damit auch Dissipation im System. Ein weiterer Effekt der
die rheologische Beschreibung erschwert ist die Deformation der
Tropfen. Um so höher die Schergeschwindigkeit ist, umso optimaler
paßt sich ein Tropfen in seiner Form und Ausrichtung den
Strömungsverhältnissen an. Dies führt bis zum Punkt
der Tropfenzerkleinerung zu einem Sinken der Viskosität mit
der Scherrate (Strukturviskoses Verhalten). Die Zirkulationsströmung
im Inneren führt zu einer zusätzlichen, viskositätssteigernden
Dissipation.
Quantitative rheologische Beziehungen für Emulsionen sind
aufgrund der oben genannten Faktoren schwierig und daher auch
selten. Für Gehalte der dispersen Phase bis 30 Vol-% empfielt
sich die Beziehung nach VERMEULEN: